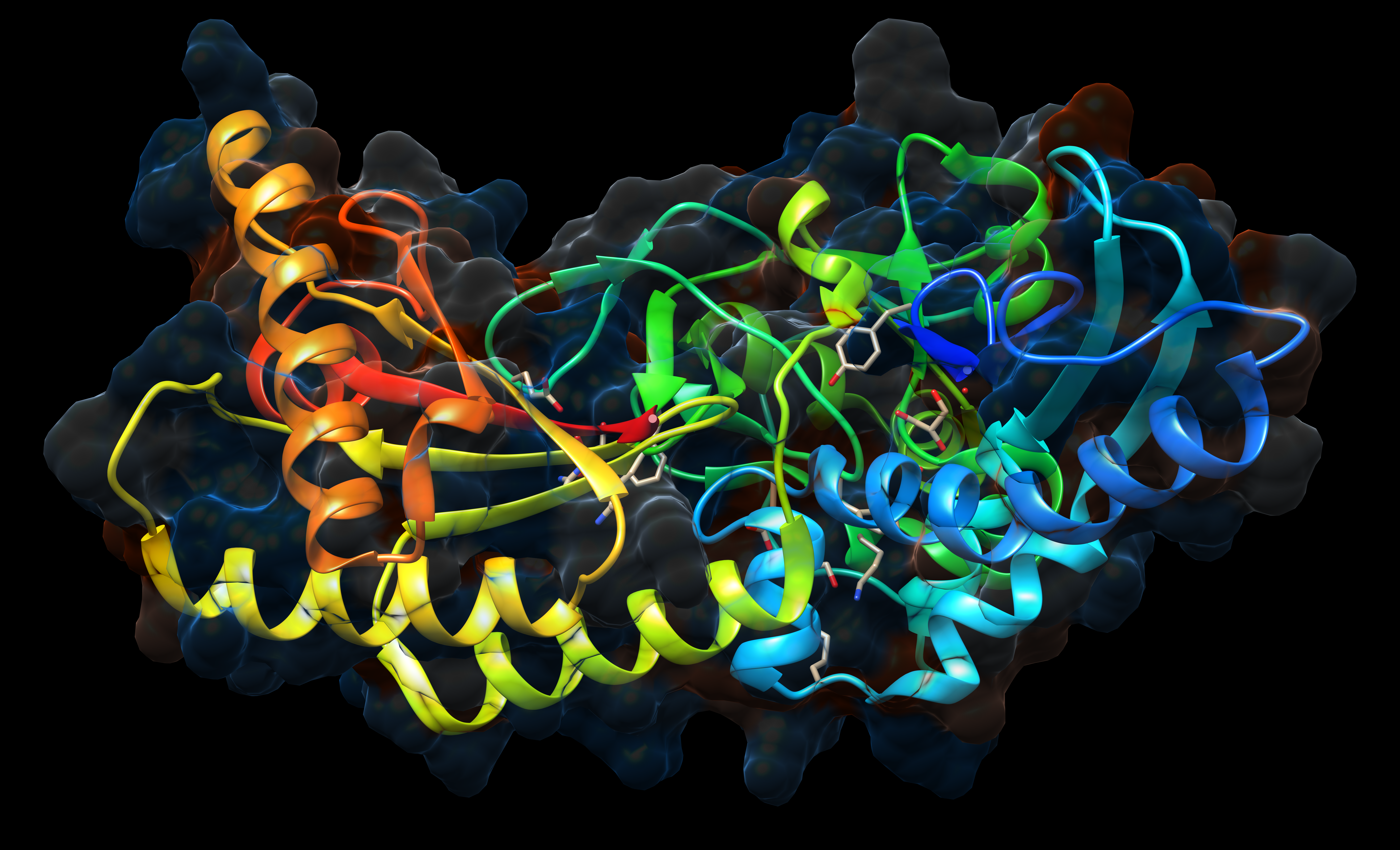
Vsak izmed nas nosi s seboj kakšno zapleteno zgodbo in tudi beljakovine niso nobena izjema. Beljakovine so dolge molekularne verige (biopolimeri), sestavljene iz več deset, več sto ali celo več tisoč aminokislin. Te makromolekule igrajo številne ključne vloge v naših telesih in so tako raznolike kot funkcije, ki jih opravljajo: celicam nudijo strukturno in gibalno funkcijo, prenašajo informacije, nadzorujejo naš metabolizem, nam omogočajo dihanje in vid. Nekatere se celo borijo proti virusom in bakterijam. Za pravilno delovanje se morajo te izjemne molekule zviti v pravilno tridimenzionalno obliko, ki jo praviloma enolično določa njeno zaporedje aminokislin. Toda ali obstajajo beljakovine, ki se naravno zvijejo v vozel? Podobno, kot bi zavozlali vozel osmice na vrvici, telefonskem kablu ali žici pri slušalkah?

Primeri treh različnih proteinskih vozlov. Levo: vozel deteljice (E. coli, pdb 1ns5), sredina: vozel osmica (beljakovina iz špinače, pdb 1yve), desno: trojno-zviti vozel (človeška ubikvitin C-terminalna hidrolaza UCH-L1, pdb 1xd3)
V matematiki se z vozli ukvarja topologija, veda, ki proučuje lastnosti geometrijskih objektov, ki se ohranjajo pri zveznih deformacijah (raztezanje, zvijanje …). Matematično je vozel definiran kot sklenjena nepretrgana krivulja v prostoru. Prva težava, s katero se soočimo, je, da so matematični vozli sklenjeni, beljakovine pa so tipično nesklenjene (imajo amino in kislinski konec), vendar to navadno ne povzroča veliko težav, saj lahko v večini primerov konca (abstraktno) sklenemo na enoličen način. Konca beljakovine se namreč v večini primerov nahajata v bližini konveksne ogrinjače beljakovine, v primerih, ko se vsaj eden od koncev nahaja nekje znotraj molekule, pa obstajajo verjetnostne sklenitve, kjer pogledamo več tisoč različnih sklenitev in izberemo najpogostejšo.

Tabela prvih nekaj matematičnih vozlov. Številki pod vozlom povesta, koliko križišč ima vozel minimalno in kateri po vrsti s toliko križišči je. Nekateri vozli pa imajo posebna imena.
Dolga leta je veljalo, da narava ne zna zavozlati proteinskega vozla, saj kinetične težave (npr. visoka aktivacijska bariera) pri oblikovanju takšne zapletene strukture ne bi prišle skozi evolucijsko sito. Prvi vozel deteljice so našli leta 1994 v beljakovini (encimu) karboanhidraza B. Ta primer vozla v današnji terminologiji imenujemo plitev vozel, ker se z odstranitvijo nekaj aminokislin z enega konca beljakovinske verige vozel razvozla. Zaradi te plitvosti je bilo v začetnem obdobju nekaj dvomov glede obstoja zavozlanih beljakovin. Raziskave na področju zavozlanih beljakovin so se razširile šele leta 2000, ko je William R. Taylor identificiral prvi globoki vozel osmice v beljakovinski izomeroreduktazi acetohidroksilne kisline. Ta vozel uvrščamo med globoke vozle, ker bi morali odstraniti 70 ostankov s karboksilnega konca ali 245 ostankov z aminskega konca, če bi želeli vozel razvozlati. Najgloblji vozel, odkrit do sedaj, sta identificirali Nicole C. H. Lim in Sophie E. Jackson leta 2015 v beljakovini Tp0642 bakterije Treponema pallidum, kjer lahko odstranimo 139 ostankov iz karboksilnega in 162 ostankov iz aminskega konca in bi še vedno vseboval vozel. Čeprav funkcija te beljakovine še ni razjasnjena, domnevajo, da vozel prispeva k nenavadni strukturi celične ovojnice, kar je lahko pomembno za patogenezo te bakterije, ki povzroča sifilis. Ravno letos pa so našli do sedaj tri najbolj zakomplicirane vozle (glejte tudi zgornjo tabelo vozlov): vozel 63 s šestimi križišči, vozel 71 s sedmimi križišči in prvi sestavljeni vozel 31#31, ki vsebuje kar dve kopiji deteljice.

Beljakovina Tp0642 z najglobljim do sedaj odkritim vozlom (pdb 5jir). Barve se spremenijo iz modre (amino konec) v rdečo (kislinski konec).
Poudariti je treba, da vozli niso posledica nekega naključnega prepletanja dolgih polipeptidnih verig, pač pa tip vozla v celoti narekuje aminokislinsko zaporedje beljakovine. Zlaganje zavozlanih beljakovin je do 10-krat počasneje kot pri nezavozlanih analogih, poleg tega je zlaganje tudi manj učinkovito, saj so pokazali, da se določene zavozlane beljakovine pravilno zvijejo samo znotraj zelo ozkega temperaturnega intervala. Kljub tem pomanjkljivostim pa imamo močne dokaze, da vozli predstavljajo evolucijsko prednost. Vozlov je razmeroma malo (okoli 1 % do sedaj odkritih beljakovin), se pa pojavijo v vseh kraljestvih življenja, kjer so se ohranili skozi evolucijo: izvor nekaterih zavozlanih beljakovin sega nazaj stotine milijonov, potencialno milijarde let. Danes vemo, da vozli beljakovini nudijo strukturne prednosti, kot sta zaščita pred degradacijo in toplotna stabilizacija. Zanimiv je tudi primer človeške beljakovine (encima) ubikvitin hidrolaze, ki se nahaja v bližini proteasoma – »stroja«, ki razgrajuje poškodovane ali nepotrebne beljakovine. Proteasom ima obliko sodčka, skozi katerega potegne beljakovino, ki jo želi razgraditi. Ubikvitin hidrolaze vsebuje precej zakompliciran trojno zviti vozel, ki preprečuje, da bi molekulo potegnilo v sam proteasom.

Razgradnja beljakovine
Razumevanje vozelnih tipov beljakovin pa je ena izmed pomembnejših tem, s katero se bomo topologi, skupaj s strukturnimi biologi, soočali v naslednjih letih. Danes ne vemo niti tega, kateri vzorci aminokislinskih zaporedij so odgovorni za vozlanje in kako poteka postopek zlaganja vozlov. Z razumevanjem beljakovinskih vozlov pa nimamo težav samo mi, temveč tudi umetna inteligenca. Program AlphaFold2 je rešil 50 let star problem zvijanja beljakovin, saj zna iz zaporedja aminokislin pravilno napovedati zlaganje skoraj vseh beljakovin, nepravilne napovedi pa ima pogosto ravno pri beljakovinah, ki vsebujejo vozel.
Razumevanje oblik in tvorbe vozlov ima potencialne aplikacije tudi pri načrtovanju zdravil (ena od beljakovin, vključenih v SARS-CoV 2, ima topologijo drsnega vozla). Pravzaprav je topologija šele zadnje čase pokazala, da ima ogromno aplikacij na praktično vseh področij znanosti in tehnologije, na primer aplikacije v medicini, arhitekturi, robotiki in računalniških znanjih. Zagotovo pa bomo našli še mnogo drugih uporab teorije vozlov – če bomo le dovolj zviti!